从实验室到疫苗前线:LNP的60年核酸递送革命
传递遗传信息到体内目标细胞内部一直是基因治疗面临的主要挑战。这一障碍现在正在被克服,近年来,基于脂质的系统,特别是脂质纳米粒子(LNPs),在实现核酸疫苗和治疗剂的递送方面取得了显著进展。
在这里我们基于脂质纳米粒子(LNPs)在核酸递送中60年发展历程,详细介绍了脂质体和脂质复合物的发展、脂质纳米粒子递送系统的开发以及未来的展望。
LNP在核酸递送中60年发展历程
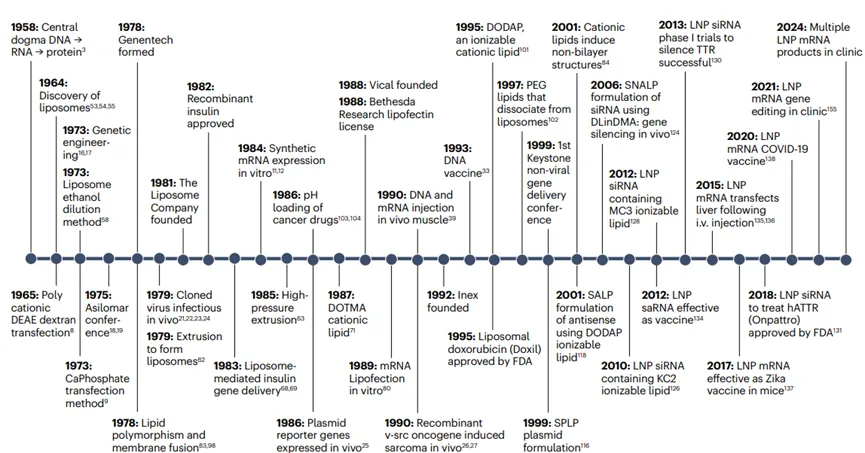
1958年,分子生物学的中心法则被提出,即DNA到RNA再到蛋白质的信息流,这为后续的基因治疗和RNA疫苗的发展奠定了理论基础;1964年到1973年期间,脂质体(liposomes)和钙-磷酸盐-DNA共沉淀法被发现,这为后续的LNP技术提供了技术原型;1981年,病毒载体进行基因治疗的概念被提出,这一概念对后续LNP技术的发展产生重要影响;1984年,重组痘苗病毒的开发为RNA疫苗的发展提供了参考;1989年,一些非病毒方法被用于疫苗开发;1990年代中期,LNP技术发展进入关键时期,Inex Pharmaceuticals和UBC开始合作研究,开发基于脂质的核酸递送系统;1995年到1999年期间,LNP技术中关键的脂质成分离子化的可电离阳离子脂质DODAP稳定质粒脂质体(SPLP)被开发,标志着LNP技术进入新阶段。
2001年到2012年期间,稳定反义脂质体(SALP)、稳定核酸脂质体(SNALP)配方和LNP siRNA相继被开发出来,使得LNP技术得到了进一步发展;2015年到2024年期间,LNP技术在mRNA递送方面的发展及应用,标志着LNP技术在疫苗领域的成功应用(图1)。LNP技术从早期的脂质体研究到现代RNA疫苗和疗法的60年的发展历程,每一步都为最终的成功应用奠定了基础。
脂质体的形成和结构
脂质体是在水中分散的脂质形成的多层囊泡,通常由一个或多个脂质双层组成,这些双层围绕一个或多个水性腔室。脂质双层由两排磷脂分子组成,其中磷脂的亲水性头部朝向水相,而疏水性尾部相互面对,形成稳定的结构。同时,为了提高脂质体的循环时间和靶向性,脂质体表面可以修饰聚乙二醇(PEG)等聚合物,以减少免疫系统的识别和清除。
由于脂质体可以通过内吞作用进入细胞,随后在内体或溶酶体中与膜融合,释放其包裹的内容物。因此脂质体可以作为药物和基因治疗剂的载体。脂质体在药物递送和基因治疗中起关键作用,脂质体的稳定性、循环特性、细胞摄取效率都会对最终的治疗效果产生极大影响。
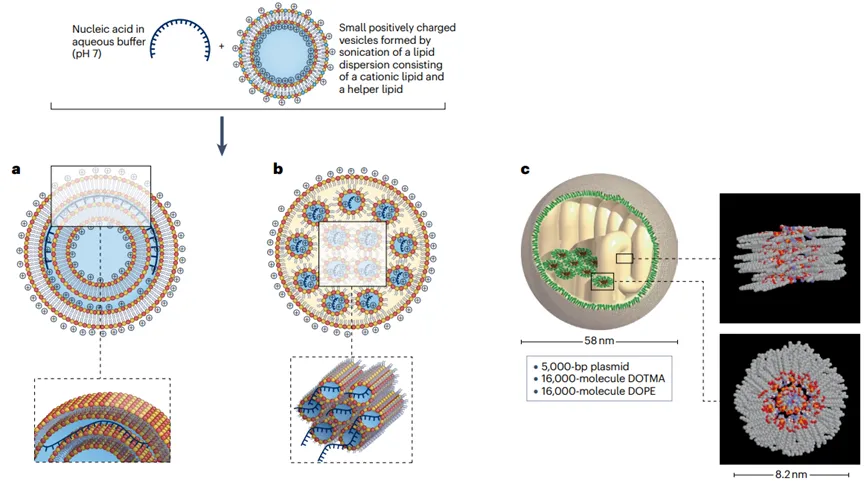
脂质纳米颗粒(LNPs)的形成过程
LNP的形成是一个复杂的过程,涉及精确的化学和物理操作,以确保核酸的有效包裹和递送。这些颗粒的设计允许它们在体内循环,特异性地靶向和进入细胞,最终释放其核酸货物,用于疫苗开发、基因治疗和其他治疗应用。
LNP由四种主要脂质成分组成,包括可电离脂质(或阳离子脂质)、辅助脂质、胆固醇和聚乙二醇化脂质(PEG-脂质)。
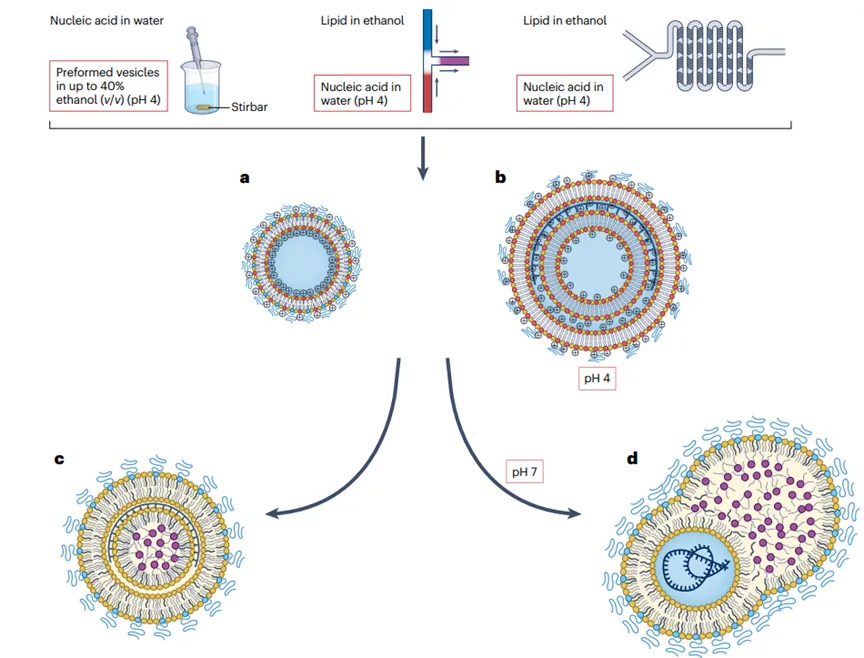
这些脂质首先在有机溶剂(如乙醇)中溶解,形成均匀的脂质溶液;之后将含有核酸(如mRNA)的水相溶液与脂质的有机相溶液快速混合。在混合过程中,可电离脂质在水相中质子化,带正电荷,与带负电荷的核酸磷酸骨架发生静电结合。然后在混合后的溶液中,脂质成分由于疏水作用和范德华力相互作用,自发组织成纳米结构实体。
这一过程中,脂质成分围绕核酸形成多层囊泡或纳米结构核心。再然后通过改变PEG-脂质的量或混合参数(如流速和体积比),调节LNP的大小和均匀性。此外,通过透析或切向流过滤提高pH值,中和可电离脂质,形成不带电的纳米脂质颗粒。最后通过挤压、透析和过滤消毒等后处理步骤,以确保LNP的均匀性、稳定性,并去除未封装的货物和多余的脂质成分。
LNP的形成过程对其最终的物理化学性质和生物分布具有重要影响。例如,LNP的大小、表面电荷(Zeta电位)、包封效率和颗粒浓度等特性,都会影响其在体内的药代动力学和药效学行为。因此,优化LNP的制备方法和配方组成,对于提高核酸药物的递送效率和治疗效果至关重要。
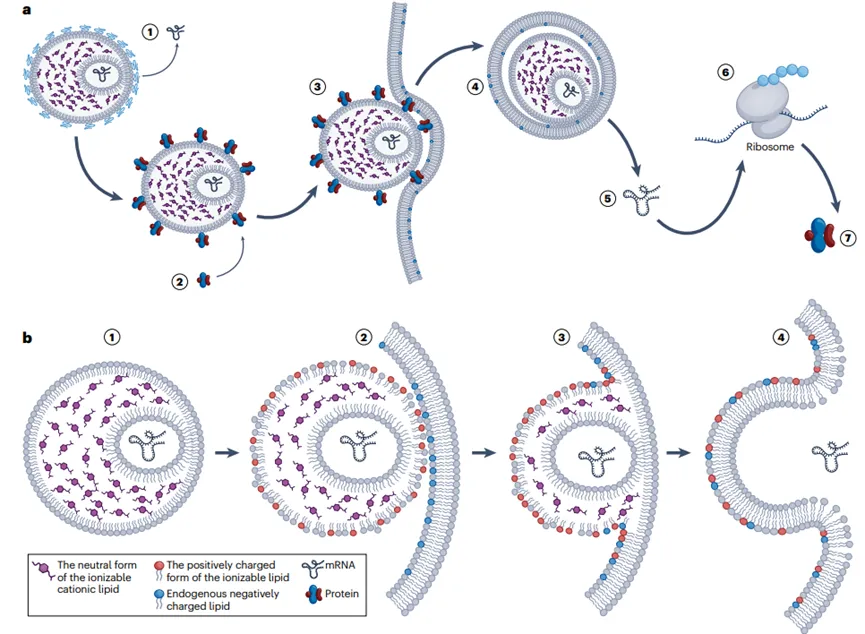
LNP mRNA传递系统的作用机制
脂质纳米粒(LNP)作为mRNA的传递系统,其作用机制涉及多个步骤,确保mRNA安全有效地递送到目标细胞并表达蛋白。
首先LNP的脂质外壳可以保护mRNA免受外界环境(如血液、组织液)中核酸酶的降解,确保mRNA的稳定性。LNPs会通过受体介导的内吞作用被细胞摄取,LNP被细胞摄取后,会进入内涵体。可电离脂质在内涵体的酸性环境中质子化,带正电荷,这有助于破坏内涵体膜,使LNP能够逃逸到细胞质中。内涵体逃逸后,mRNA从LNP中释放出来,进入细胞质。
释放的mRNA在细胞质中被核糖体识别并翻译成相应的蛋白质。翻译后的蛋白质在细胞内或分泌到细胞外,发挥其生物学功能。LNP的脂质成分在完成递送任务后,会在细胞内逐渐被生物降解,释放出的成分可以被细胞再利用或排出体外。基于这一作用机制LNPs在保护mRNA、促进细胞内传递、以及激活免疫反应方面发挥关键作用。
当前LNP技术的应用
脂质纳米粒(LNP)技术作为一种先进的药物递送系统,已经在多个领域显示出其广泛的应用潜力。
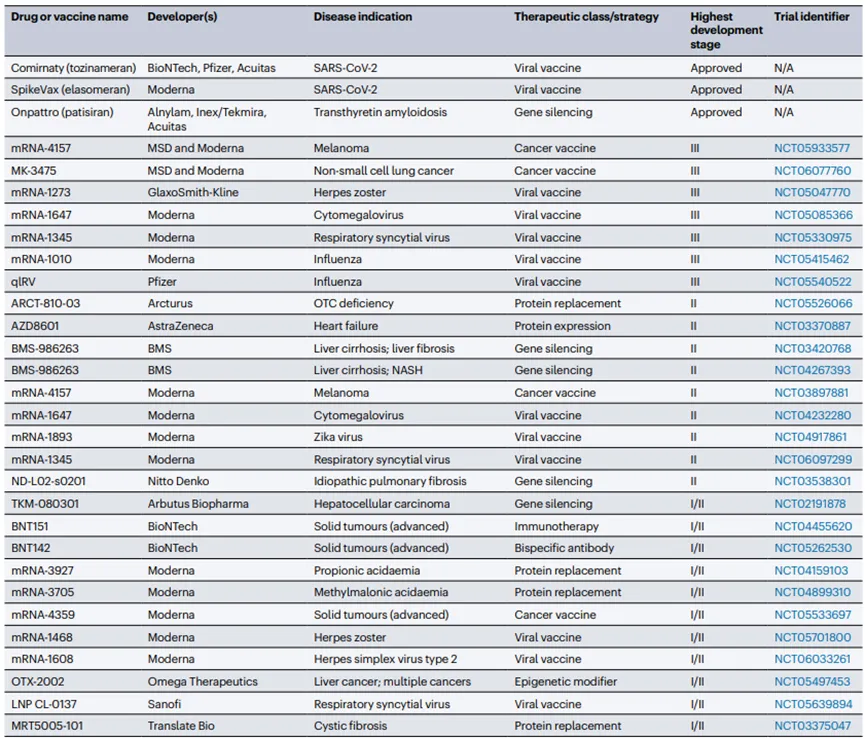
LNP技术在COVID-19 mRNA疫苗的开发中发挥了关键作用,成功实现了mRNA的高效递送至人体细胞内,激发免疫反应,目前有60多种使用LNP递送技术的疫苗和治疗剂已经获得批准或正在进行临床开发,其中30种已经进展到超过第一阶段的临床试验。
此外运用LNP来封装siRNA或mRNA,可以实现对肿瘤组织的靶向性药物递送,从而实现对癌症的治疗。通过将Cas9 mRNA和sgRNA封装在LNP中,也可实现对特定基因的精确编辑。
LNP也能够作为蛋白质替代疗法递送编码治疗性蛋白的mRNA,用于治疗由蛋白质缺陷引起的遗传性疾病。针对一些罕见遗传病,LNP技术可以封装特定的基因编辑组件或治疗性mRNA,为这些疾病提供潜在的治疗方案等。LNP技术的多功能性和适应性使其在生物医学领域具有广泛的应用前景,随着研究的深入和技术的优化,预计将有更多的基于LNP递送的核酸药物上市,为多种疾病提供新的治疗策略。
写在最后
总的来说,基于LNP的系统在核酸疫苗和治疗剂递送方面的显著成功正在引领新一代基因治疗的到来。这些系统在遗传容量、重新剂量能力、可扩展性、制造简易性、成本低廉以及开发高度个性化的靶向治疗方面,展现出了超越病毒和其他递送系统的压倒性优势。
基于LNP递送系统启用的基因治疗的未来前景显然是变革性的。
参考文献:The 60-year evolution of lipid nanoparticles for nucleic acid delivery






 我要投稿
我要投稿





